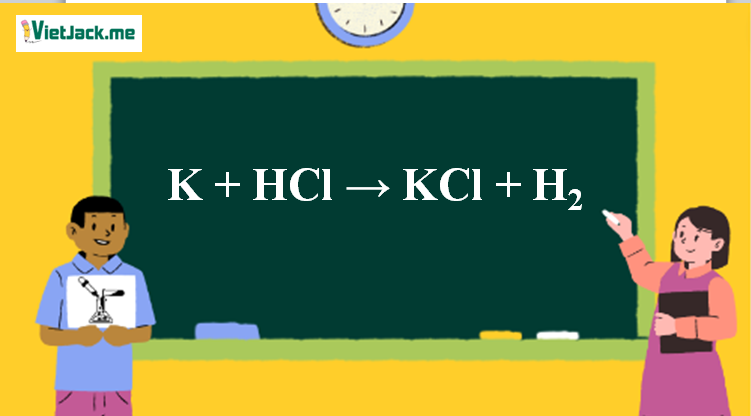
K + HCl → KCl + H2 là phản xạ lão hóa khử. Bài viết lách này hỗ trợ vừa đủ vấn đề về phương trình chất hóa học và đã được thăng bằng, ĐK những hóa học nhập cuộc phản xạ, hiện tượng lạ (nếu có), ... Mời chúng ta đón xem:
Phản ứng K + HCl → KCl + H2
1. Phản ứng hóa học
K + 2HCl → KCl + H2
2. Điều khiếu nại phản ứng
Không cần thiết điều kiện
3. Cách tiến hành phản ứng
Cho natri thuộc tính với axit clohidric tạo ra muối
4. Hiện tượng phân biệt phản ứng
K tan dần dần vô hỗn hợp HCl và đem khí bay rời khỏi.
5. Bản hóa học của những hóa học nhập cuộc phản ứng
5.1. Bản hóa học của K (Kali)
- Trong phản xạ bên trên K là hóa học khử.
- K là sắt kẽm kim loại kiềm đem tính khử cực mạnh, tham gia phản xạ với những axit như HCl, H2SO4....
5.2. Bản hóa học của HCl (Axit clohidric)
- Trong phản xạ bên trên HCl là hóa học oxi hoá.
- HCl thuộc tính với sắt kẽm kim loại đứng trước H vô sản phẩm hoạt động và sinh hoạt chất hóa học (trừ Pb) tạo ra trở thành muối hạt và khí hidro.
6. Tính hóa học hoá học tập của K
Kali là sắt kẽm kim loại kiềm đem tính khử cực mạnh.
K → K+ + 1e
6.1. Tác dụng với phi kim
6.2. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
6.3. Tác dụng với nước
K thuộc tính mạnh mẽ với nước và tự động rực rỡ tỏa nắng tạo ra trở thành hỗn hợp kiềm và hóa giải khí hidro.
2K + 2H2O → 2KOH + H2.
6.4. Tác dụng với hidro
Kali thuộc tính với hidro ở áp suất tương đối lớn và sức nóng phỏng khoảng tầm 350 – 400oC tạo ra trở thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
7. Tính hóa học vật lí của Kali
- Kali là sắt kẽm kim loại nhẹ nhàng loại nhì sau liti, là hóa học rắn rất rất mượt, đơn giản dễ dàng rời vị dao và đem white color bạc.
- Kali bị ôxi hóa rất rất thời gian nhanh vô không gian và cần được bảo vệ vô dầu lửa hoặc dầu mỏ.
- Có lượng riêng rẽ là 0,863 g/cm3; đem sức nóng nhiệt độ chảy là 63,510C và sôi ở 7600C.
8. Tính hóa học hoá học tập của HCl
Dung dịch axit HCl đem vừa đủ đặc điểm hoá học tập của một axit mạnh.
8.1. Tác dụng hóa học chỉ thị
Dung dịch HCl thực hiện quì tím hoá đỏ ửng (nhận biết axit)
HCl → H+ + Cl-
8.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H vô sản phẩm Bêkêtôp) tạo ra muối hạt (với hóa trị thấp của kim loại) và hóa giải khí hidrô (thể hiện tại tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không tồn tại phản ứng
8.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo ra muối hạt và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
8.4. Tác dụng với muối hạt (theo ĐK phản xạ trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng nhằm phân biệt gốc clorua )
Ngoài đặc điểm đặc thù là axit , hỗn hợp axit HCl quánh còn thể hiện tại tầm quan trọng hóa học khử Lúc thuộc tính hóa học oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn ăn ý 3 thể tích HCl và 1 thể tích HNO3 quánh được gọi là lếu láo ăn ý nước cường toan (cường thuỷ) đem kỹ năng hoà tan được Au (vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
9. Câu căn vặn vận dụng
Câu 1. Hòa tan trọn vẹn a gam K vô 100 ml hỗn hợp HCl 1M, thấy bay rời khỏi V lít khí (dktc). Giá trị của V là:
A. 1,12 lit B. 11,2 lít
C. 5,6 lít D. 2,24 lít
Lời giải:
Đáp án A
Phương trình phản ứng: K + 2HCl → KCl + H2
nH2 = nHCl/2 = 0,50% = 0,05 mol ⇒ VH2 = 0,05.22,4 = 1,12 lít
Câu 2. Cho a g K thuộc tính với hỗn hợp HCl dư nhận được 2,24 lít khí đktc và m g muối hạt. Giá trị của m là:
A. 0,585 g B. 5,85 g
C. 11,7 g D. 1,17 g
Lời giải:
Đáp án C
Phương trình phản ứng: K + 2HCl → KCl + H2
nKCl = 2.nH2 = 2.0,1 = 0,2 mol ⇒ mKCl = 74,5.0,2 = 14,9 g
Câu 3. Dãy nào là tại đây chỉ bao gồm những sắt kẽm kim loại thuộc tính với hỗn hợp HCl:
A. Cu; Na, Ag B. Na, K, Fe
C. Cu, K, Na D. Na, Ag, Ca
Lời giải:
Đáp án B
Phương trình phản ứng:
2Na + 2HCl → 2NaCl + H2;
2K + 2HCl → 2KCl + H2;
Fe + 2HCl → FeCl2 + H2.
Xem tăng những phương trình phản xạ chất hóa học khác:
K + H2SO4 → K2SO4 + H2
K + H3PO4 → K3PO4 + H2
K + H3PO4 → K2HPO4 + H2
K + H3PO4 → KH2PO4 + H2
K + HF → KF + H2